肺和气管是人体和外界进行气体交换的唯一路径。当呼吸系统终末期疾病出现,例如终末期的肺纤维化、慢阻肺,良恶性的气管狭窄、气管阻塞等,唯一的呼吸路径被损毁,会造成致死性的呼吸困难。通过移植的方式,对损毁的呼吸通道进行重建,是目前唯一有效的治疗方式。然而,移植物的来源、移植物转运、移植过程中的多学科配合、移植术后的监测与风险预防等,都是对移植成功的巨大挑战。
上海肺移植工程技术研究中心依托美高梅附属上海市肺科医院,是国内最早开展肺移植的单位之一。中心主任陈昶教授秉承“让患者畅快呼吸”的愿景,立足多学科、医工交叉,深耕移植相关的临床和基础研究。近日,陈昶教授团队围绕肺移植与气管移植的历史性难题展开合作,并取得多项科研成果。以陈昶教授作为通讯作者的2篇原创性论文分别发表在国际高水平学术期刊Signal Transduction and Targeted Therapy和Science Translational Medicine上。
STTT:肺移植后肠道微生物群与同种异体移植物稳定性相关
肺移植术是治疗终末期肺部疾病的重要治疗手段,然而手术后的并发症,尤其是同种异体移植排斥(AR)和肺部感染(PI),仍然是患者面临的重大挑战。这些并发症不仅会影响患者的生存率,还会降低手术的成功率。为了解决这一问题,需要深入了解肺移植患者术后的机体相关生物学过程。近期,由美高梅附属上海市肺科医院陈昶教授、海军军医大学方文捷教授和潘炜华教授等杰出科学家组成的研究团队,在Signal Transduction and Targeted Therapy上在线发表了题为“Intestinal microbiota links to allograft stability after lung transplantation: a prospective cohort study”的前瞻性研究论文。该研究是国际上首个揭示肠道微生物与肺移植同种异体移植物稳定性之间联系的多中心研究,同时也为未来的肺移植研究和治疗提供了新的靶点与方向。

研究团队在4个不同的肺移植中心建立了一个前瞻性队列,涵盖了来自4个中心的85例肺移植受者(LTRs)。同时进一步收集了这些肺移植患者术后成对的粪便和血清标本,并根据采样时的诊断将样本分为AR、PI和无事件(EF)组。通过宏基因组测序法对粪便样本进行了深入分析,结果显示AR的肠道微生物组表现出明显的减少物种和多样性的特征。同时,针对血清标本及临床信息的进一步检测分析揭示了AR和PI的血清代谢物减少和炎症细胞因子增加。值得注意的是,单形拟杆菌(Bacteroides uniformis)在AR中的减少与血清中IL-1β和IL-12存在显著的负相关关系,这为肠道微生物群落影响肺移植术后移植物稳定性提供了新的机制解释。此外,该研究还进一步联合微生物组、代谢组和临床参数构建了能够高效预测AR(AUPRC=0.801)和PI(AUPRC=0.855)的机器学习模型,其中微生物组数据集显示出特别高的诊断鉴别能力。总之,破坏性肠道微生物群与同种异体移植排斥和感染以及肺移植后的全身细胞因子和代谢物显著相关。
此项研究的重要性不仅在于揭示了肠道微生物与肺移植稳定性之间的深刻联系,还在于为未来的研究提供了重要的方向,更为此后的进一步机制实验指明了道路。了解肠道微生物群的作用可能有助于预测和预防AR和PI等严重并发症的发生,提高肺移植术后患者的生存率和生活质量。
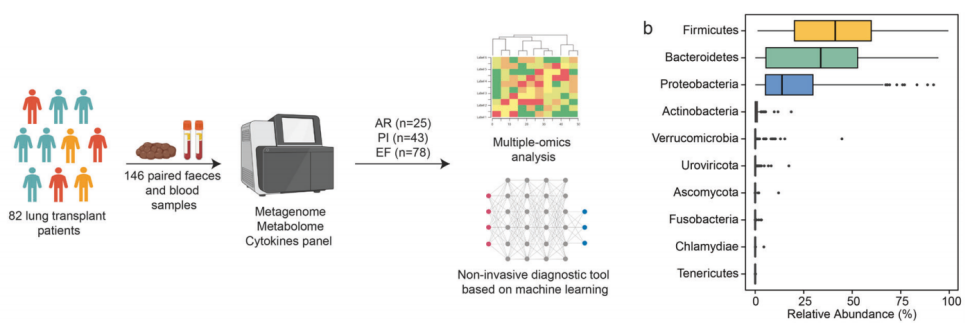
研究流程示意图
STM:3D打印构建可移植活性气管

气管作为人体气体交换的唯一通道,出现阻塞可能随时夺去患者生命。气管肿瘤、外伤或先天性疾病均可能导致气管狭窄阻塞的出现。手术切除并进行端-端吻合是临床常用手段。但当病损范围过长,端-端吻合会造成过大的吻合口张力,导致气管瘘、气管破裂等严重并发症,而非活性的气管替代物也因为并发症严重,无法临床应用。因此,长段气管狭窄患者无法手术,只能保守治疗短暂延长生命,临床亟需可移植的活性气管,替换气管病损部位,帮助患者维持呼吸功能。然而气管组织结构复杂,长期暴露于外界空气中导致感染风险高、损伤愈合难度大,可移植的活性气管一直被全球医学界认为无法再造。近期,美高梅陈昶团队和浙江大学贺永团队合作,基于3D打印超细纤维网络支架构建一种生物工程气管,同时模拟天然气管的解剖结构和生物功能,并形成益于再生的免疫微环境,在实验动物气管缺损模型的修复中展示出较高的临床潜力。相关工作“A bioengineered trachea-like structure improves survival in a rabbit tracheal defect model”发表于专注于转化医学研究的Science子刊Science Translational Medicine。
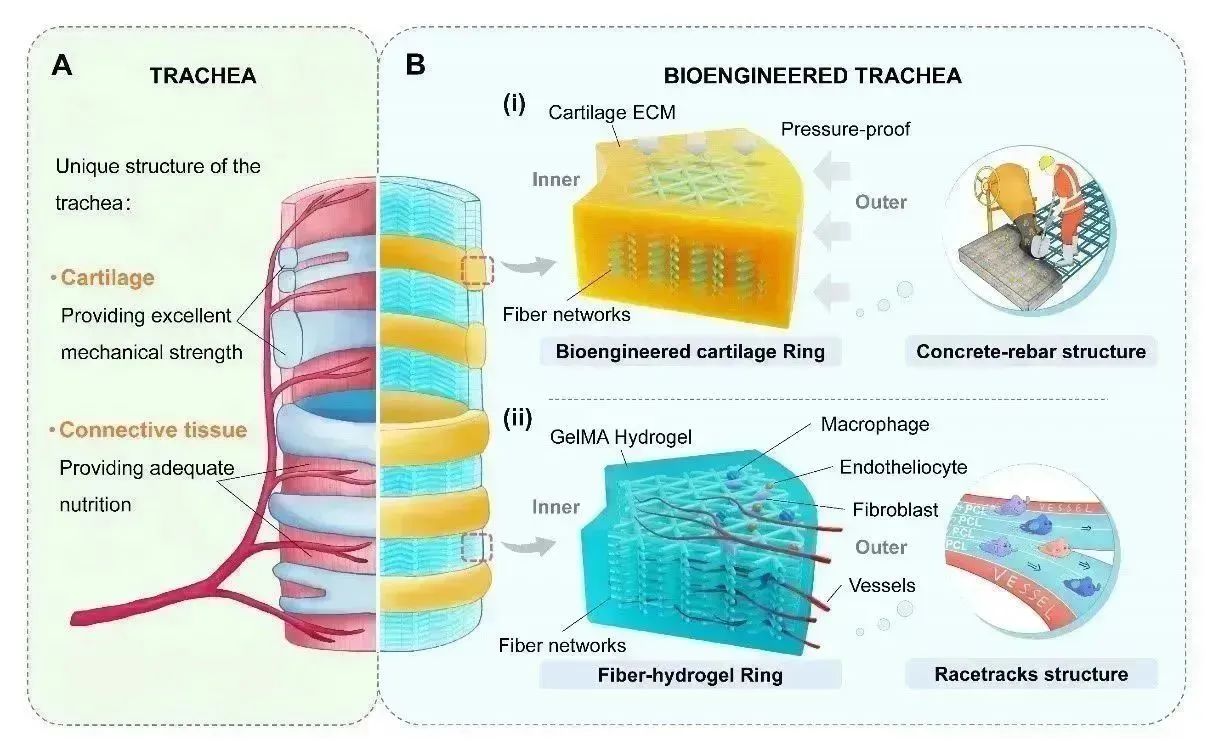
活性气管的设计和制造思路
该研究引入熔融近场直写(MEW)技术,以FDA批准的可降解材料聚己内酯(PCL)作为原料,通过优化支架内部网格排列形式和孔隙大小等参数,制备生物工程气管替代物基本骨架,为气管中的软骨及结缔组织的重建,营造一个仿生的ECM结构环境。
团队首先在MEW制备的超细纤维支架上接种软骨细胞,进行体外软骨诱导培养,形成气管替代物构建的基本模块:纤维-软骨环。有序排列的超细纤维与软骨基质蛋白联合,形成近似“钢筋-混凝土”的复合体,产生显著的力学协同增强作用,极大提升了生物工程软骨环的机械强度。
为促进透壁血管快速生成和调节免疫发育微环境,研究团队设计了由PCL超细纤维网络和甲基丙烯酰胺明胶(GelMA)制备另一基本模块——纤维-凝胶环。在纤维-凝胶环中,由外向内排布的PCL超细纤维作为细胞黏附表面,为细胞快速迁移提供了“竞速跑道”,加快原生内皮细胞和炎症细胞的跨壁迁移,促进透壁血管再生。此外,MEW可以在微米尺度调节PCL超细纤维网络内部结构,能够调控细胞形态和机械应力,具有促进内皮细胞分化和诱导巨噬细胞的极化潜能,这将有助于移植气管周边组织快速再生和炎症缓解。
最终,研究团队从组织发育和器官移植需求出发,采用“体外塑形”+“体内塑性”的思路,将受体作为组织发育生物反应器,采用预血管化后带蒂原位移植方案,完成长段缺损气管的重建。将生物工程软骨环和纤维-凝胶环交替套叠,构建类气管替代物,随后将其植入实验动物气管旁完成预血管化。移除实验动物天然气管构建气管缺损模型,再将替代物带蒂与原生气管残端吻合,重建实验动物缺损气管。研究通过生物制造、组织工程和临床医学的多学科交叉合作,模拟天然气管的解剖结构和生物功能进行仿生设计,构建的气管替代物存在潜在临床应用价值。
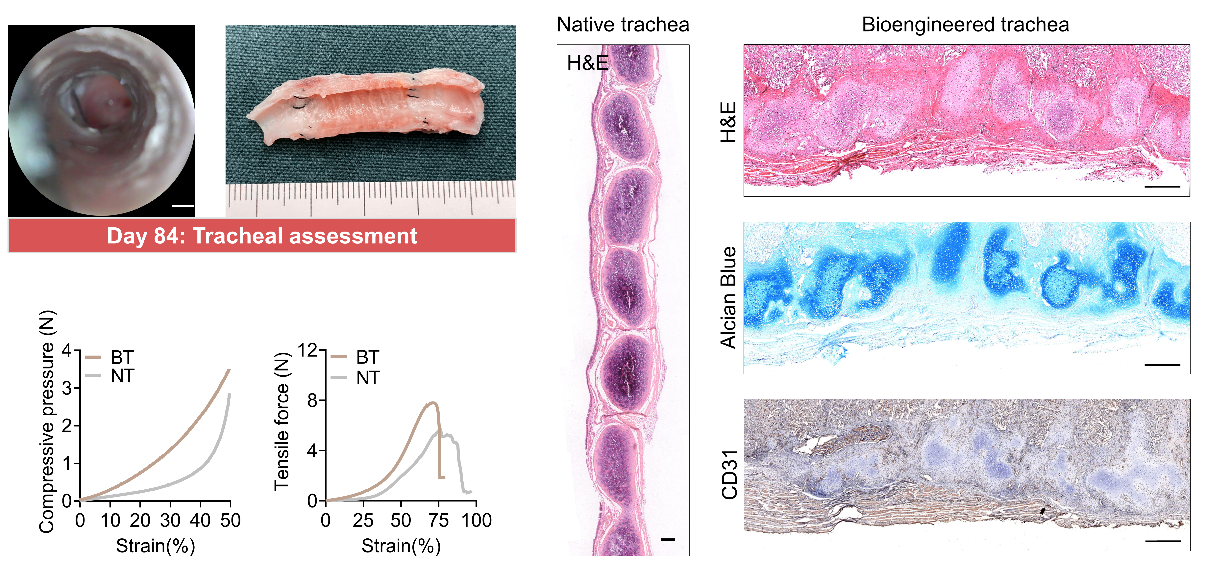
生物工程气管用于实验动物气管缺损模型修复
上海肺移植工程技术研究中心是上海地区最大的肺移植相关科研与临床转化的多学科平台。中心依托美高梅附属上海市肺科医院在移植学、免疫学及组织工程学等的学科优势,围绕肺移植技术创新、移植肺的保存及功能修复、肺移植后免疫微环境重塑与免疫治疗以及干细胞外泌体与再生医学、生物组织工程等前沿领域,先后在创新肺移植外科技术、降低移植物缺血再灌注损伤、促进肺移植后免疫耐受等关键问题上实现了科研及临床转化的双重突破。
上海肺移植工程技术研究中心建设依托单位美高梅附属上海市肺科医院是国内最早开展肺移植的单位之一,自2003年成功开展第一例肺移植手术以来,先后开创亚洲首例再次肺移植、国内首例活体肺叶移植等多个国内、国际第一。研究中心依托附属上海市肺科医院胸外科,整合呼吸重症、麻醉科、肺循环科等重点学科优势资源,组建多学科联合协作的肺移植专业团队和专职队伍,并设立专属肺移植病区及重症监护病房。2020年中心获批“上海肺移植工程技术研究中心”,能够开展单肺移植、双肺序贯移植、活体肺叶移植、肺再移植及肺移植同期联合双侧肺减容等覆盖所有术式的肺移植手术。中心在国内率先实现肺移植受者ECMO跨院转运、直升机航空跨省运肺、国内首个EVLP应用于边缘供体的修复与监测,保证急危重症患者抢救性肺移植成功实施。中心肺移植手术量现居上海第一、全国第四,生存率高于全国平均水平,接近国际先进水平。