阿尔茨海默病(Alzheimer’s disease, AD)是一种进行性神经退行性疾病,常伴有记忆丧失、智力丧失、社交和情感功能障碍等症状,病理特征包括脑内淀粉样蛋白(Aβ)聚集形成的老年斑、过度磷酸化的Tau蛋白聚集形成的神经元纤维缠结(nft)、慢性炎症反应、突触丧失和神经元死亡。最近的研究也表明,在许多大脑中没有老年斑和神经原纤维缠结的阿尔茨海默病患者中,突触的形态和功能已经明显退化,甚至一些神经元已经死亡,因此突触丢失被认为是早期AD认知障碍最明显的形态学相关因素。最近研究也发现转录调控因子可调节突触可塑性。此外,AD大脑中许多转录调控因子发生了显著变化,而这些转录因子在AD中的作用尚不清楚。
Maf1是一种高度保守的蛋白,可作为RNA聚合酶III的转录调节因子,通过激活PTEN通路在肿瘤、糖代谢、脂质代谢等方面发挥重要作用。Maf1在中枢神经系统中也有高表达,尤其是在海马和皮层中。Maf1可通过PI3K-AKT-mTOR信号通路负向调节海马神经元树突生长,负向调节树突棘生长,影响小鼠体内学习记忆能力。因此,通过探索Maf1在AD疾病进展中的作用和潜在功能,有可能进一步阐明AD突触重塑的机制。
1月16日,美高梅附属东方医院神经内科李刚团队在Brain杂志上发表了题为“Maf1 loss regulates spinogenesis and attenuates cognitive impairment in Alzheimer’s disease” 的文章,该研究发现,在阿尔茨海默病中转录调控因子Maf1表达升高,通过与Grin1的启动子区结合而调节NMDAR1的表达,进一步调节钙稳态,影响神经元突触形态和功能,最终改善AD小鼠的突触功能以及认知功能。

阿尔茨海默病(AD)是一种以进行性认知障碍为特征的神经退行性疾病。突触功能障碍出现在阿尔茨海默病的早期,并与认知障碍显著相关。越来越多的研究转录调控作为一个决定性因子可以影响神经元生长的多个方面,包括神经元的极化与迁移、轴突的生长与导向、树突的生长与分支以及突触的发生。然而,AD大脑中许多转录调控因子发生了显著变化,具体的调控机制尚不清楚。考虑到转录因子作用的特点,研究人员设想在AD中发生变化的转录因子是否能调控神经元突触相关基因的表达,从而影响突触可塑性,发挥改善认知的作用。
研究人员通过对人脑GEO数据库GSE5281进行基因组研究,找到AD与正常海马组织之间的所有差异基因,发现在AD患者海马中Maf1的表达水平有显著升高趋势。同时原代海马神经元AD模型与APP/PS1小鼠海马中Maf1蛋白水平均显著升高。(图1)。
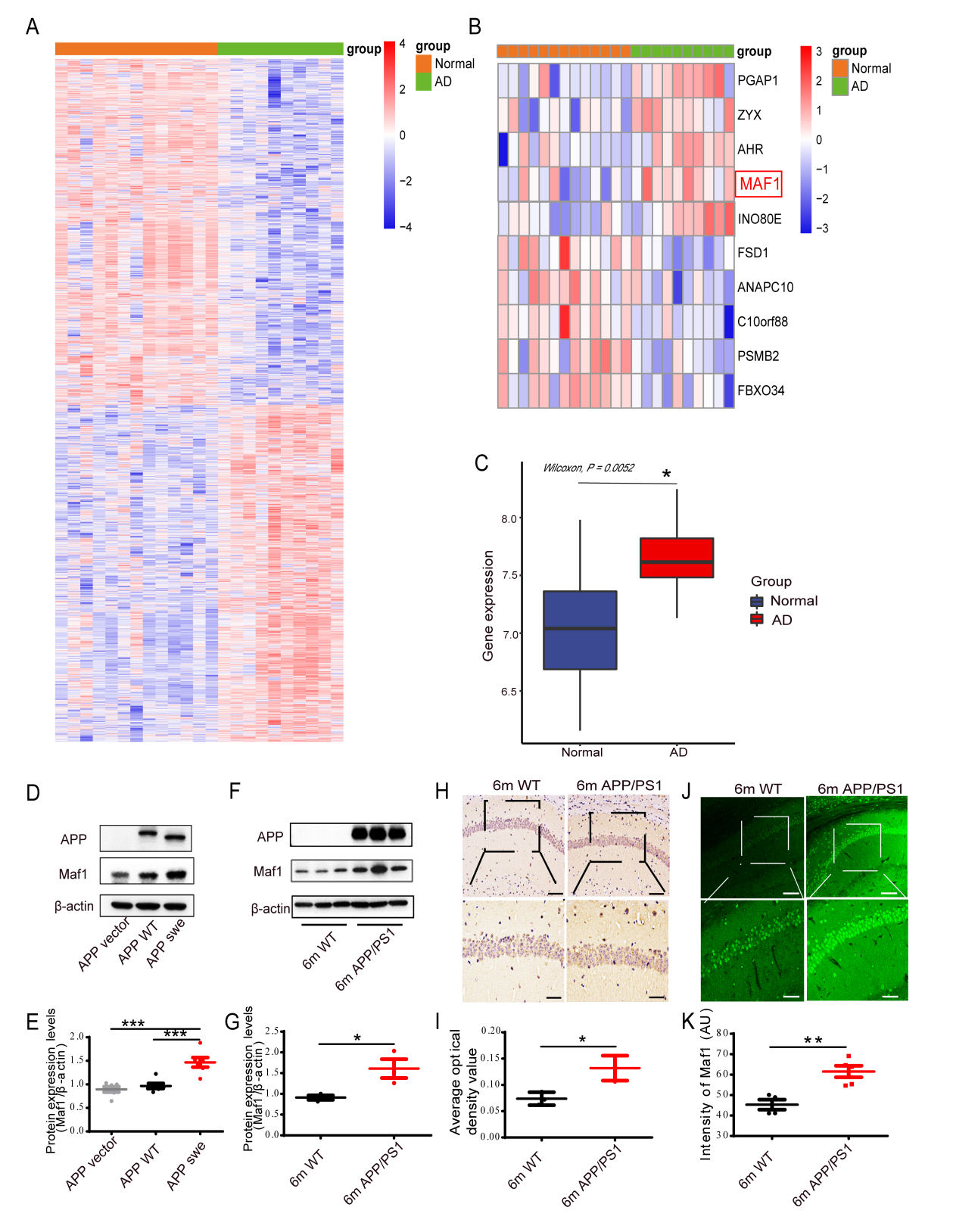
图1 AD患者和APP/PS1小鼠中Maf1表达增加
研究人员利用CRISPR/ Cas9介导的基因工程技术构建了Maf1条件性敲除小鼠,与AD转基因小鼠杂交后,探究条件性敲除Maf1后对学习和记忆功能的影响(图2)。

图2 条件性敲除Maf1可改善AD小鼠的学习记忆功能
研究人员发现在AD转基因小鼠及体外AD模型中,条件性敲除Maf1后神经元树突棘总数量明显增多,而且成熟树突棘的百分比的比例也明显提高,这说明Maf1在AD疾病中对神经元树突的形态具有调控作用(图3)。
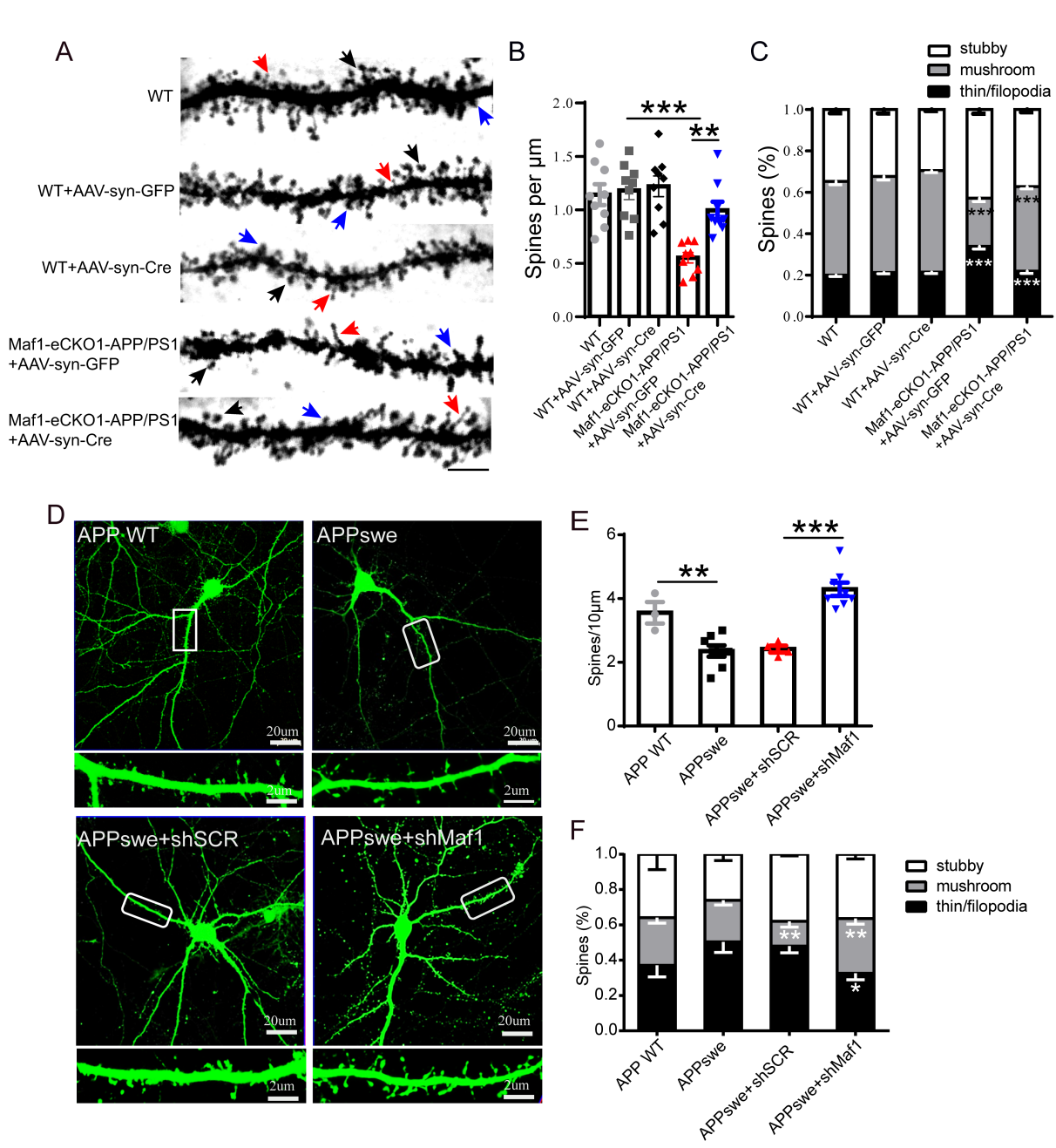
图3 海马中Maf1条件敲除可促进AD神经元树突棘的成熟
然而,这种形态的恢复是否能改善神经生理功能障碍吗?因此,研究人员进一步检测了小鼠海马突触可塑性的变化,观察到AD小鼠海马神经元中mEPSC的频率降低,而敲减了Maf1后恢复到WT水平。因此,研究人员认为条件性敲除Maf1可以恢复海马突触可塑性(图4)。
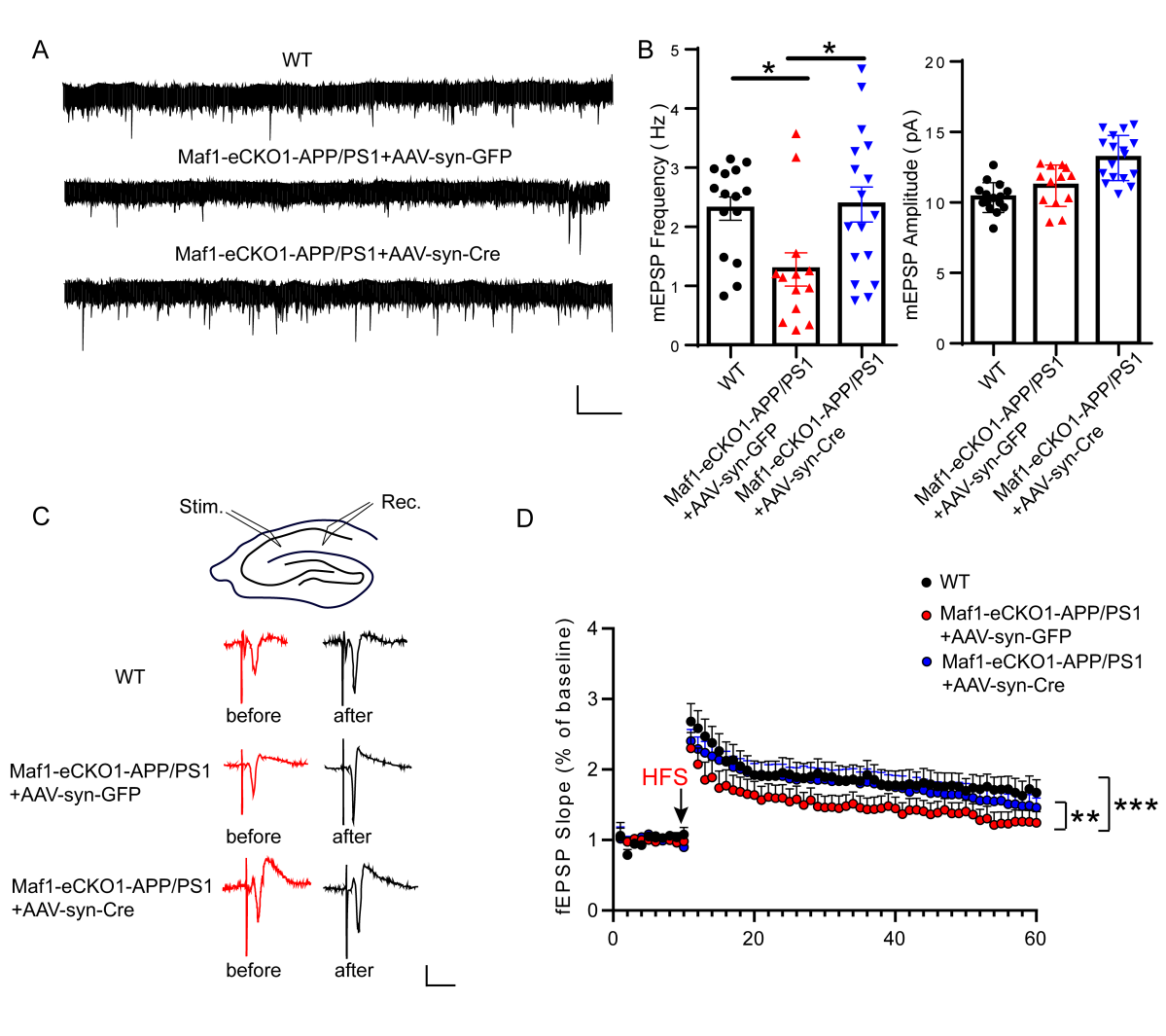
图4 条件性敲除Maf1可挽救AD小鼠突触功能障碍
为了探索Maf1调控神经元突触功能的机制,研究人员进行转录组学测序(图5)。GO富集分析和KEGG通路分析表明,下调基因主要与突触、钙离子信号通路和神经相关的配体受体反应有关。
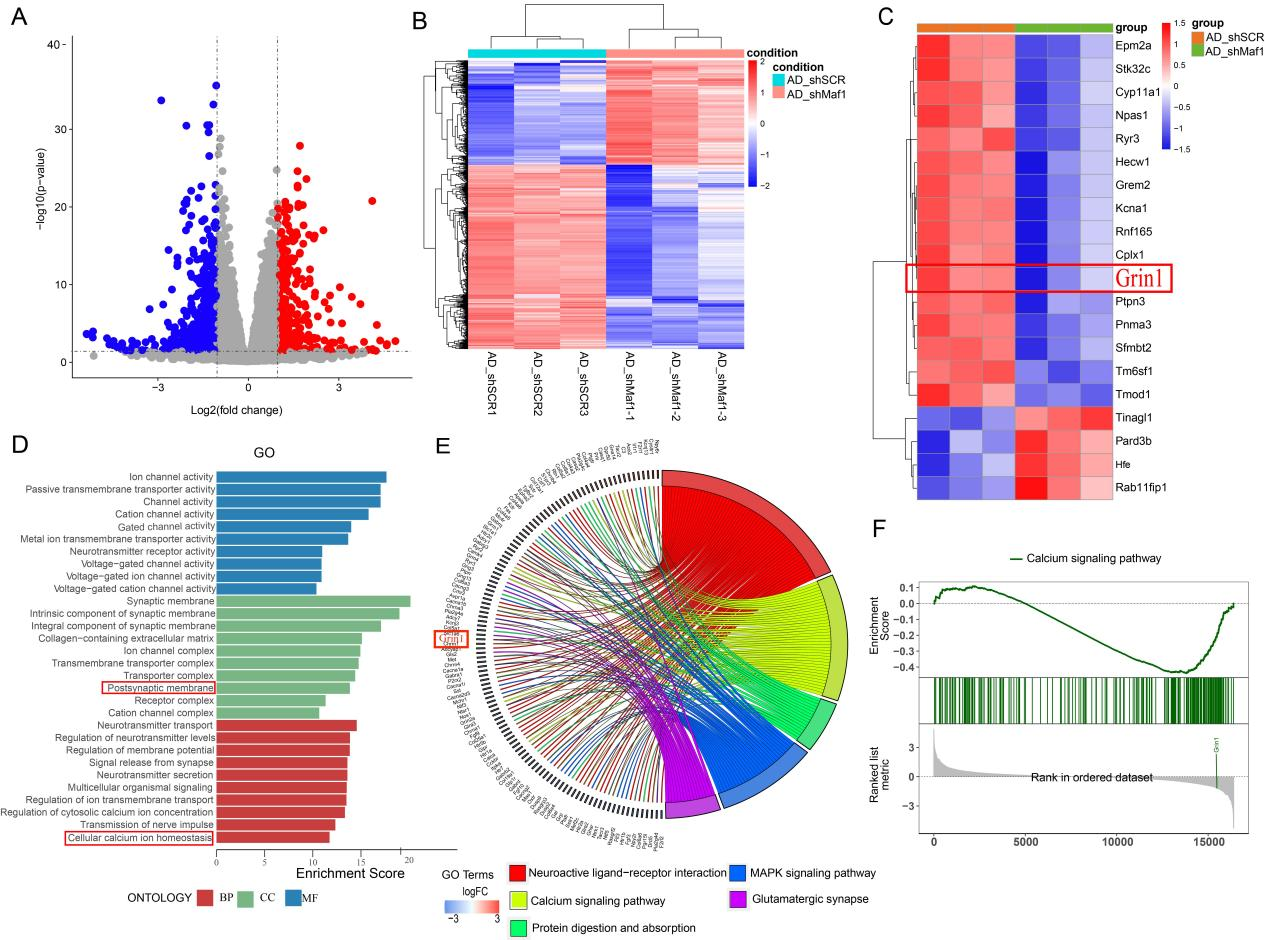
图5 RNAseq分析提示Maf1调控下游基因Grin1参与钙信号通路和突触功能
CUT&Tag实验进一步探讨了Maf1在AD中调节突触重塑的机制(图6)。GO分析和KEGG分析表明突触与钙离子信号通路和谷氨酸突触密切相关。通过蛋白相互作用网,发现Grin1位于核心位置,这表明Maf1-NMDAR1可能通过调节AD中钙稳态来调节突触功能。
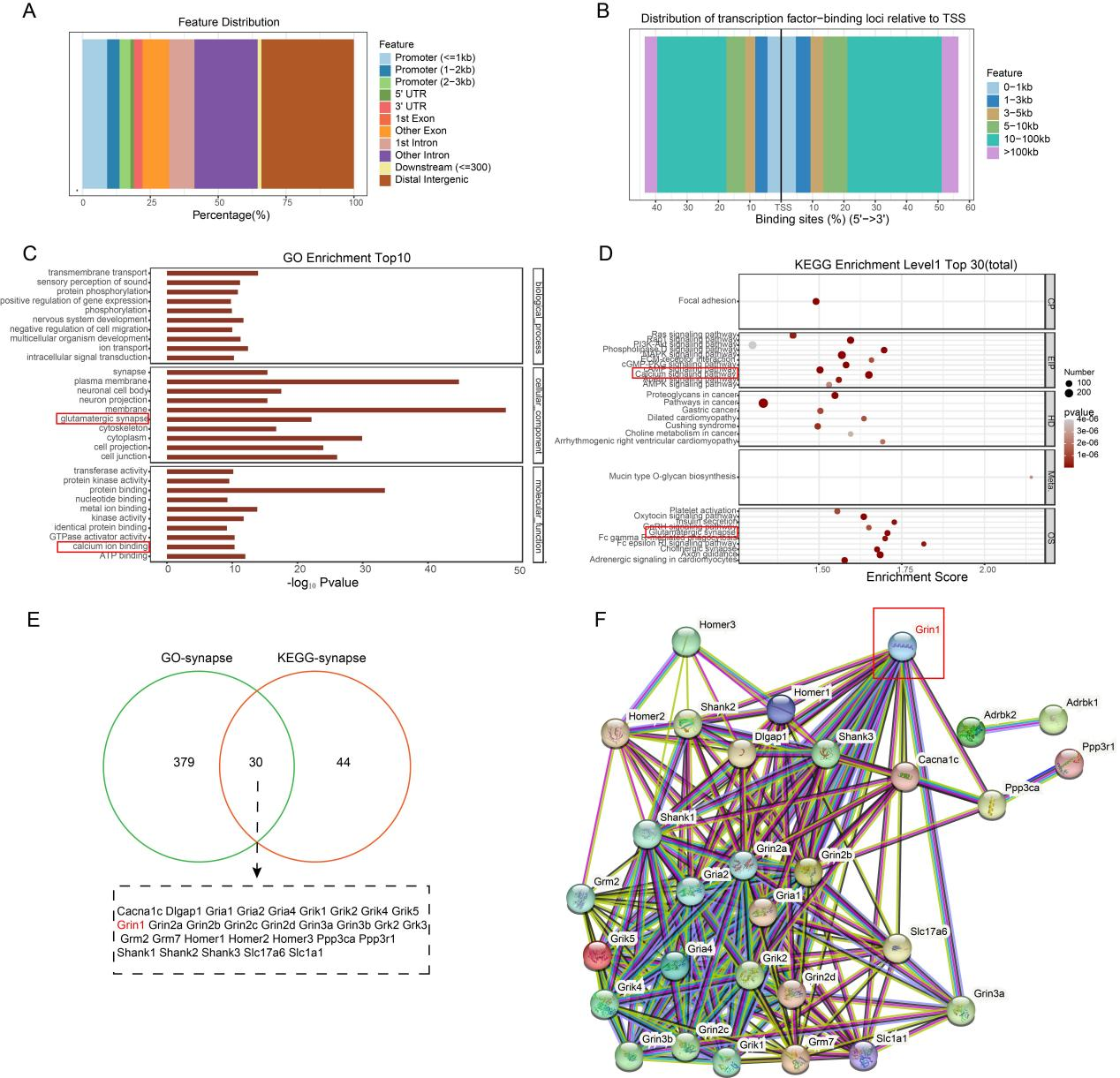
图6 CUT&Tag测序显示Maf1和Grin1基因之间存在蛋白- DNA相互作用
总的来说,研究人员表明,转录调节因子Maf1在AD中表达增加,通过与Grin1的启动子区结合,调节NMDAR1的表达,进一步调节钙稳态,改变树突棘的形态结构和数量,从而影响突触功能。最终,它调节突触重塑并影响学习和记忆功能(图7)。
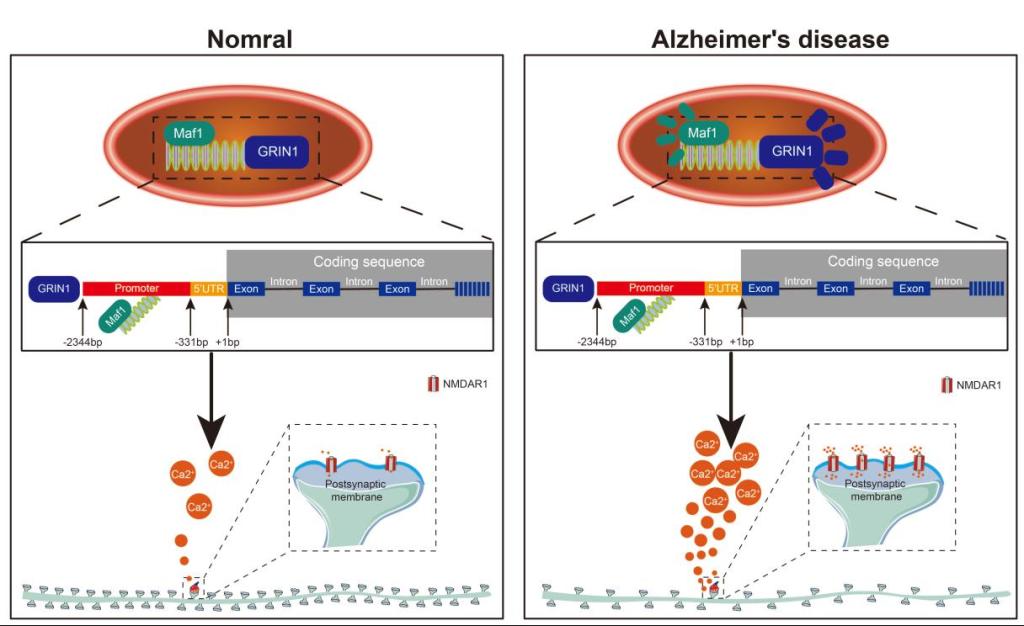
图7 Maf1-NMDAR1信号通路调控神经元钙稳态并参与阿尔茨海默病突触重塑的机制
本研究聚焦于神经元突触重塑相关的转录调控因子Maf1,研究结果阐明了Maf1-NMDAR1信号通路在AD发病过程对于突触结构、神经元功能和认知行为的影响,有可能成为AD早期发病的潜在诊断和治疗靶点。需要说明的是,虽然我们探索了神经元中Maf1对Grin1基因的调控作用,但在AD疾病进展中胶质细胞中Maf1是否发挥功能还需要进一步研究。
相关研究成果于2024年1月16日在线发表在Brain杂志上。李刚教授为通讯作者,张贝博士为共同通讯作者,课题组韩颖颖博士为第一作者。
通讯作者简介
李刚,美高梅附属东方医院神经内科教授、主任医师、博士研究生导师
研究方向:脑卒中院前院内急救及脑损伤后神经功能的修复。
科研工作:牵头多项多中心随机对照临床研究(INTERACT4, OPTIMISTIC等),先后承担国家重点研发计划、国家自然科学基金等多项国家级课题,在Brain、Neurology、Stroke等杂志发表SCI论文50余篇。
原文链接:https://pubmed.ncbi.nlm.nih.gov/38226680/